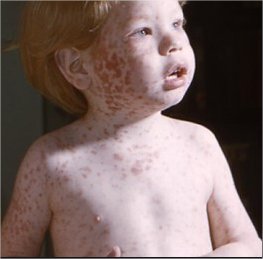
Le virus de la rubéole (RUBV) est un agent pathogène humain important qui peut provoquer une éruption cutanée systémique bénigne à la suite d’une infection aiguë, mais de graves malformations congénitales si une infection maternelle aiguë survient au cours du premier trimestre de la grossesse. Il s’agit d’un virus à ARN simple, à brin plus, qui se réplique dans le cytoplasme de la cellule infectée. Le RUBV est taxonomiquement unique, étant le seul membre du genre Rubivirus de la famille des Togaviridae et n’est apparenté qu’à distance à ses plus proches parents, les membres du genre Alphavirus de la famille des Togaviridae et le virus de l’hépatite E genre Hepevirus, famille non désignée pour le moment). Les anomalies congénitales induites par le RUBV, connues collectivement sous le nom de syndrome de rubéole congénitale (SRC), sont dues à une infection directe du fœtus et peuvent toucher plusieurs systèmes d’organes, notamment les yeux, les oreilles, le cœur, le cerveau et le système endocrinien. La pathogenèse du SRC n’est pas comprise et les patients atteints du SRC sont constamment infectés par le RUBV à la naissance et peuvent souffrir de séquelles progressives en plus de celles apparentes à la naissance. Des vaccins vivants atténués contre la rubéole sont utilisés dans les pays développés depuis plus de 30 ans avec d’excellents résultats et sont maintenant appliqués dans le cadre de programmes d’élimination dans certaines régions du monde en développement.
Aspects moléculaires du virus
Une nucléocapside icosaédrique renferme l’ARN génomique du virus de la rubéole. Une enveloppe bicouche lipidique d’origine cellulaire entoure la nucléocapside et est incorporée au moment du bourgeonnement. Deux glycoprotéines spécifiques du virus, E1 et E2, dépassent de l’enveloppe du virion sous forme de pointes. Les réponses des anticorps humoraux sont dirigées contre la glycoprotéine E1. Les protéines virales des pics sont à l’origine des étapes menant à l’adhésion, à la fusion et à la pénétration dans les cellules. Nombre de ces actions n’ont pas été définies dans l’infection par la rubéole, bien que l’on pense que la E1 facilite l’adhésion aux globules rouges et déclenche l’infection virale. Une fois à l’intérieur de la cellule, le bourgeonnement des capsides pour former des virions se produit au niveau de l’appareil de Golgi ou de la membrane cytoplasmique. Dans les lignées cellulaires de culture de mammifères, les infections persistantes sont facilement établies car la réplication du virus de la rubéole ne nuit pas à la synthèse macromoléculaire à l’intérieur de la cellule. Un autre facteur contribuant à la persistance de la rubéole est la capacité de bourgeonner dans le cytoplasme des cellules et donc d’être protégé de la réponse humorale de l’hôte. Le virus provoque le ralentissement ou l’arrêt de la division cellulaire in vivo, ce qui serait responsable de la diminution de la taille des organes chez les nouveau-nés.
Virologie
Le virus de la rubéole est classé comme un togavirus et est le seul membre du genre Rubivirus. Contrairement aux autres togavirus qui causent l’encéphalite équine de l’Est et de l’Ouest et sont classés comme des virus transmis par les arthropodes, le virus de la rubéole est connu pour n’infecter que des hôtes vertébrés et l’homme est le seul réservoir naturel connu du virus de la rubéole. Le virus de la rubéole est un virus à ARN enveloppé d’un seul type antigénique qui ne présente pas de réaction croisée avec d’autres togavirus. Le virus de la rubéole peut être cultivé dans plusieurs lignées cellulaires courantes de laboratoire. Le séquençage du génome de la rubéole monocaténaire d’environ 10 000 nucléotides a été achevé. Divers animaux de laboratoire peuvent être infectés par le virus de la rubéole, bien qu’il n’existe pas de modèle animal fiable d’infection symptomatique par la rubéole chez l’homme ou de syndrome de rubéole congénitale.
Conséquences
Le RV infecte les cellules permissives via une endocytose à médiation par récepteur. La protéine E1 du RV se lie au récepteur et induit une fusion des membranes. Le récepteur cellulaire insaisissable du RV n’a été identifié que récemment comme étant la glycoprotéine oligodendrocytaire de la myéline (MOG) (Cong et al., 2011) après des travaux impliquant que les glycoprotéines étaient essentielles pour l’entrée du RV dans les cellules.
En général, le virus se réplique d’abord dans les voies respiratoires supérieures et dans le tissu lymphoïde nasopharyngien, se propageant de là vers les ganglions lymphatiques régionaux (Cooper et Buimovici-Klein, 1985), (Wolinsky et al., 1996). Le virus de la rubéole infecte les lymphocytes, les cellules B et les cellules CD4 +/CD8 + T .
Plusieurs protéines cellulaires interagissent avec le génome du virus de la rubéole ou ses protéines. La calréticuline, une protéine chaperon du réticulum endoplasmique, interagit avec l’extrémité 3′ de l’ARN du virus de la rubéole, tandis que Ro/SS-A et La/SS-B semblent interagir avec l’élément cis de la boucle de la tige 5′(+) du virus. La protéine du rétinoblastome impliquée dans la régulation de la croissance cellulaire interagit avec la protéine p90 du virus de la rubéole, ce qui pourrait contribuer à la tératogenèse (Lee et Bowden, 2000). La calréticuline et la calnexine s’associent aux protéines E1 et E2 dans le réticulum endoplasmique (Nakhasi et al, 2001). La p32 cellulaire, la protéine de liaison C1q, interagit avec le domaine N-terminal de la capside du virus de la rubéole. La surexpression de p32 dans les lignées cellulaires augmente l’infectivité du virus de la rubéole.
Dans les cellules infectées par le virus de la rubéole, l’actine se dépolymérise en filaments à la fin de l’infection, bien que les changements microtubulaires ne soient pas apparents. L’infection par le virus de la rubéole peut être associée à une inhibition du développement des cellules précurseurs des organes. Une interférence avec l’assemblage de l’actine peut contribuer à la tératogenèse.
Les particules du noyau du virus de la rubéole s’associent aux mitochondries. Les modifications morphologiques et biochimiques des mitochondries se produisent au début de l’infection. L’énergie mitochondriale et les protéines de stress et de chaperon des mitochondries sont élevées (examiné dans (Lee et Bowden, 2000)). L’infection à RV augmente les complexes de la chaîne respiratoire avec une induction marginale du stress oxydatif .
Bien que le virus de la rubéole puisse établir des infections persistantes et non cytocidaires, il peut également provoquer des effets cytopathiques dus à la mort des cellules apoptotiques. Les déterminants cytopathogènes ont été mis en correspondance avec les protéines non structurelles du virus de la rubéole (Pugachev et al, 1997).
L’immunité se produit après une infection naturelle et n’est pas due à des anticorps dirigés contre la glycoprotéine E2, car ceux-ci disparaissent relativement rapidement, mais est due à des anticorps dirigés contre la glycoprotéine E1 qui persistent pendant des décennies.
Virus de la rubéole
T.K. Frey, dans l’Encyclopédie de la virologie (troisième édition), 2008
Le virus de la rubéole (RUBV) est un agent pathogène humain important qui peut provoquer une éruption cutanée systémique bénigne à la suite d’une infection aiguë, mais de graves malformations congénitales si une infection maternelle aiguë survient au cours du premier trimestre de la grossesse. Il s’agit d’un virus à ARN simple, à brin plus, qui se réplique dans le cytoplasme de la cellule infectée. Le RUBV est taxonomiquement unique, étant le seul membre du genre Rubivirus de la famille des Togaviridae et n’est apparenté qu’à distance à ses plus proches parents, les membres du genre Alphavirus de la famille des Togaviridae et le virus de l’hépatite E (genre Hepevirus, famille non désignée pour le moment). Les anomalies congénitales induites par le RUBV, connues collectivement sous le nom de syndrome de rubéole congénitale (SRC), sont dues à une infection directe du fœtus et peuvent toucher plusieurs systèmes d’organes, notamment les yeux, les oreilles, le cœur, le cerveau et le système endocrinien. La pathogenèse du SRC n’est pas comprise et les patients atteints du SRC sont constamment infectés par le RUBV à la naissance et peuvent souffrir de séquelles progressives en plus de celles apparentes à la naissance. Des vaccins vivants atténués contre la rubéole sont utilisés dans les pays développés depuis plus de 30 ans avec d’excellents résultats et sont maintenant appliqués dans le cadre de programmes d’élimination dans certaines régions du monde en développement.
Aspects moléculaires du virus
Une nucléocapside icosaédrique renferme l’ARN génomique du virus de la rubéole. Une enveloppe bicouche lipidique d’origine cellulaire entoure la nucléocapside et est incorporée au moment du bourgeonnement. Deux glycoprotéines spécifiques du virus, E1 et E2, dépassent de l’enveloppe du virion sous forme de pointes. Les réponses des anticorps humoraux sont dirigées contre la glycoprotéine E1. Les protéines virales des pics sont à l’origine des étapes menant à l’adhésion, à la fusion et à la pénétration dans les cellules. Nombre de ces actions n’ont pas été définies dans l’infection par la rubéole, bien que l’on pense que la E1 facilite l’adhésion aux globules rouges et déclenche l’infection virale. Une fois à l’intérieur de la cellule, le bourgeonnement des capsides pour former des virions se produit au niveau de l’appareil de Golgi ou de la membrane cytoplasmique. Dans les lignées cellulaires de culture de mammifères, les infections persistantes sont facilement établies car la réplication du virus de la rubéole ne nuit pas à la synthèse macromoléculaire à l’intérieur de la cellule. Un autre facteur contribuant à la persistance de la rubéole est la capacité de bourgeonner dans le cytoplasme des cellules et donc d’être protégé de la réponse humorale de l’hôte. Le virus provoque le ralentissement ou l’arrêt de la division cellulaire in vivo, ce qui serait responsable de la diminution de la taille des organes chez les nouveau-nés.
Virologie
Le virus de la rubéole est classé comme un togavirus et est le seul membre du genre Rubivirus. Contrairement aux autres togavirus qui causent l’encéphalite équine de l’Est et de l’Ouest et sont classés comme des virus transmis par les arthropodes, le virus de la rubéole est connu pour n’infecter que des hôtes vertébrés et l’homme est le seul réservoir naturel connu du virus de la rubéole. Le virus de la rubéole est un virus à ARN enveloppé d’un seul type antigénique qui ne présente pas de réaction croisée avec d’autres togavirus. Le virus de la rubéole peut être cultivé dans plusieurs lignées cellulaires courantes de laboratoire. Le séquençage du génome de la rubéole monocaténaire d’environ 10 000 nucléotides a été achevé. Divers animaux de laboratoire peuvent être infectés par le virus de la rubéole, bien qu’il n’existe pas de modèle animal fiable d’infection symptomatique par la rubéole chez l’homme ou de syndrome de rubéole congénitale.
Conséquences
Le RV infecte les cellules permissives via une endocytose à médiation par récepteur. La protéine E1 du RV se lie au récepteur et induit une fusion des membranes. Le récepteur cellulaire insaisissable du RV n’a été identifié que récemment comme étant la glycoprotéine oligodendrocytaire de la myéline (MOG) (Cong et al., 2011) après des travaux impliquant que les glycoprotéines étaient essentielles pour l’entrée du RV dans les cellules.
En général, le virus se réplique d’abord dans les voies respiratoires supérieures et dans le tissu lymphoïde nasopharyngien, se propageant de là vers les ganglions lymphatiques régionaux (Cooper et Buimovici-Klein, 1985), (Wolinsky et al., 1996). Le virus de la rubéole infecte les lymphocytes, les cellules B et les cellules CD4 +/CD8 + T.
Plusieurs protéines cellulaires interagissent avec le génome du virus de la rubéole ou ses protéines. La calréticuline, une protéine chaperon du réticulum endoplasmique, interagit avec l’extrémité 3′ de l’ARN du virus de la rubéole, tandis que Ro/SS-A et La/SS-B semblent interagir avec l’élément cis de la boucle de la tige 5′(+) du virus. La protéine du rétinoblastome impliquée dans la régulation de la croissance cellulaire interagit avec la protéine p90 du virus de la rubéole, ce qui pourrait contribuer à la tératogenèse (Lee et Bowden, 2000). La calréticuline et la calnexine s’associent aux protéines E1 et E2 dans le réticulum endoplasmique (Nakhasi et al, 2001). La p32 cellulaire, la protéine de liaison C1q, interagit avec le domaine N-terminal de la capside du virus de la rubéole. La surexpression de p32 dans les lignées cellulaires augmente l’infectivité du virus de la rubéole.
Dans les cellules infectées par le virus de la rubéole, l’actine se dépolymérise en filaments à la fin de l’infection, bien que les changements microtubulaires ne soient pas apparents. L’infection par le virus de la rubéole peut être associée à une inhibition du développement des cellules précurseurs des organes. Une interférence avec l’assemblage de l’actine peut contribuer à la tératogenèse.
Les particules du noyau du virus de la rubéole s’associent aux mitochondries. Les modifications morphologiques et biochimiques des mitochondries se produisent au début de l’infection. L’énergie mitochondriale et les protéines de stress et de chaperon des mitochondries sont élevées (examiné dans (Lee et Bowden, 2000)). L’infection à RV augmente les complexes de la chaîne respiratoire avec une induction marginale du stress oxydatif.
Bien que le virus de la rubéole puisse établir des infections persistantes et non cytocidaires, il peut également provoquer des effets cytopathiques dus à la mort des cellules apoptotiques. Les déterminants cytopathogènes ont été mis en correspondance avec les protéines non structurelles du virus de la rubéole.
L’immunité se produit après une infection naturelle et n’est pas due à des anticorps dirigés contre la glycoprotéine E2, car ceux-ci disparaissent relativement rapidement, mais est due à des anticorps dirigés contre la glycoprotéine E1 qui persistent pendant des décennies.